Prionen sind spezielle Proteine, die im Gehirn gebildet werden. Im Normalfall sind sie harmlos. Treten die Prionen in einer zur Naturform abweichenden Faltung – also in einer anderen dreidimensionalen Form – auf, können die Proteine zusammenklumpen, sie aggregieren. Darüber hinaus können fehlgefaltete Proteine andere Prionproteine mit korrekter Faltung dazu veranlassen, sich ebenfalls umzufalten. Diese fehlgefalteten Proteine werden mit neurodegenerativen Erkrankungen wie der Creutzfeld-Jacob-Krankheit beim Menschen, BSE beim Rind oder Scrapie beim Schaf in Verbindung gebracht.
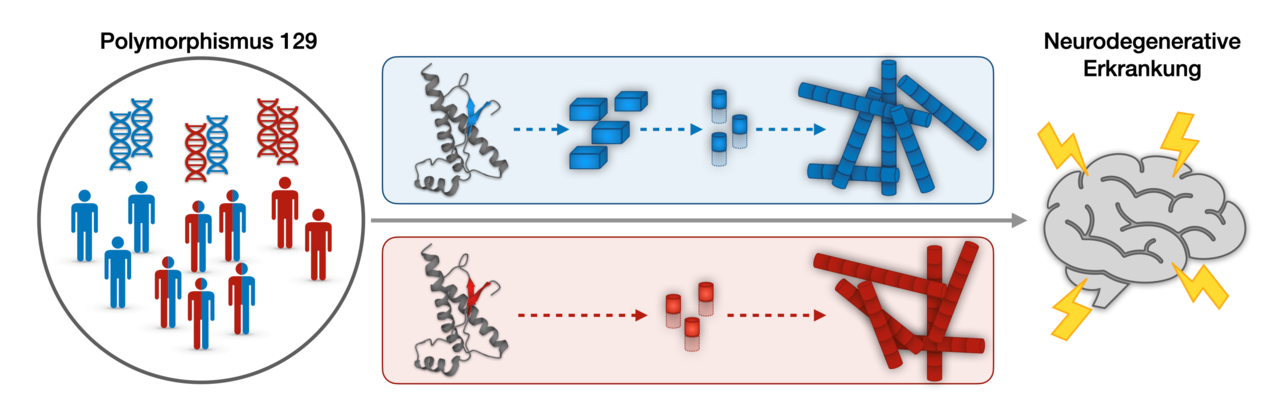
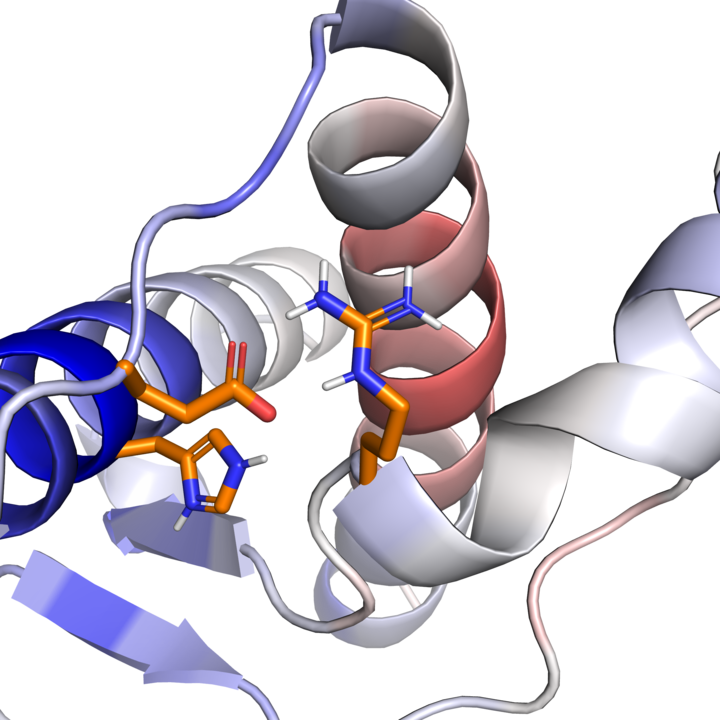
Im Menschen gibt es zwei natürliche Varianten des Prionproteins, die sich lediglich durch eine unterschiedliche Aminosäure (Methionin, kurz Met, oder Valin, kurz Val) unterscheiden. Mit diesen Varianten hängen auch zwei Varianten der Creutzfeld-Jacob-Krankheit zusammen. Eine Erklärung dafür, wie eine abweichende Aminosäure das Krankheitsbild der CJD beeinflussen kann, gab es bisher noch nicht.
Ein Team um die Erstautoren Thomas Pauly und Najoua Bolakhrif vom Institut für Physikalische Biologie der HHU und vom Institut für Biologische Informationsprozesse – Strukturbiochemie (Leitung jeweils Prof. Dr. Dieter Willbold) konnte nun erstmals zeigen, dass sich die beiden Prionvarianten auf molekularer Ebene unterschiedlich verhalten. Die Forschenden entdeckten, dass die verschiedenen Prionvarianten unterschiedliche Fehlfaltungsprozesse durchlaufen.
Während die Val-Variante direkt aggregiert, benötigt die in der menschlichen Bevölkerung häufigere Met-Variante dazu einen Zwischenschritt, bei dem zunächst kleinere Aggregate gebildet werden. „Die Erkenntnis, dass die neurotoxischen Aggregate auf unterschiedlichen Wegen gebildet werden, kann zum Verständnis der unterschiedlichen Krankheitsbilder beitragen“, betonen Pauly und Bolakhrif.
Neben den von Prof. Willbold geleiteten Instituten war auch das Institut für Pharmazeutische und Medizinische Chemie der HHU (Leiter: Prof. Dr. Holger Gohlke) an der nun im Journal of Biological Chemistry erschienenen Studie beteiligt. Prof. Gohlke und sein Mitarbeiter Jesko Kaiser haben dabei Molekulardynamik-Simulationen durchgeführt, mit denen sie auf atomarer Ebene Wechselwirkungen feststellten, die die unterschiedlichen Stabilitäten der beiden Varianten erklären.
Originalpublikation
Thomas Pauly, Najoua Bolakhrif, Jesko Kaiser, Luitgard Nagel-Steger, Lothar Gremer, Holger Gohlke, Dieter Willbold, Met/Val129 polymorphism of the full-length human prion protein dictates distinct pathways of amyloid formation, Journal of Biological Chemistry (2022), 28. August 2022