Die Lichtmikroskopie hat Forschung, Medizin und Technik seit ihrer Entwicklung entscheidend vorangebracht. Erst mit ihr konnten Erreger sichtbar gemacht und Infektionskrankheiten so zweifelsfrei diagnostiziert werden. Doch die Lichtmikroskopie stößt an ihre Grenzen, die der deutsche Physiker Ernst Abbe im 19. Jahrhundert formulierte: Zwei Punkte können nur dann getrennt abgebildet werden, wenn ihr Abstand mindestens der halben Wellenlänge des abbildenden Lichts entspricht.
Da die Lichtwellenlänge im Bereich von 400 bis 800 Nanometer (ein Nanometer entspricht einem millionstel Millimeter) liegt, beträgt die untere Auflösungsgrenze eines Lichtmikroskops einige 100 Nanometer. Die kleinsten, gerade noch auflösbaren Zellbestandteile sind die Mitochondrien, die Kraftwerke der Zellen. Kleinere biologische Strukturen wie etwa Viren oder einzelne Proteine sind nicht darstellbar. Anderen Methoden wie die Elektronenmikroskopie bilden zwar noch deutlich kleinere Strukturen ab, sie haben aber andere Nachteile: So müssen diese zum Beispiel im Vakuum arbeiten und können somit keine lebenden Objekte und dynamische Prozesse untersuchen.
Eines der Ziele der Forschung ist es, die optische Auflösungsgrenze zu umgehen und optische Geräte zu entwickeln, die deutlich kleinere Strukturen in lebensnaher Umgebung abbilden können. Dies gelang unter anderem dem deutschen Physiker Stefan Hell (heute Max-Planck-Institut für biophysikalische Chemie in Göttingen) und den beiden US-Amerikanern Eric Betzig (Howard Hughes Medical Institute in Chevy Chase, Maryland) und William E. Moerner (Stanford University, Kalifornien). Für ihre Entwicklungen von „Superresolution Mikroskopen“ werden sie am 10. Dezember mit dem Chemie-Nobelpreis 2014 ausgezeichnet.
Sie alle verbesserten die Fluoreszenzmikroskopie. Bei dieser Art der Mikroskopie werden fluoreszierende Moleküle in die Probe eingebracht, die gezielt an bestimmte Strukturen zum Beispiel in einer Zelle koppeln. Bestrahlt man die Probe mit Licht einer bestimmten Wellenlänge, werden diese fluoreszierenden Moleküle angeregt und leuchten mit einer etwas größeren Wellenlänge zurück. Durch optische Filter sieht man nur die nachleuchtenden Bereiche. Mit dieser Methode können so die markierten Strukturen gezielt dargestellt werden, allerdings sind feinere Strukturen weiterhin nicht im Detail abbildbar.
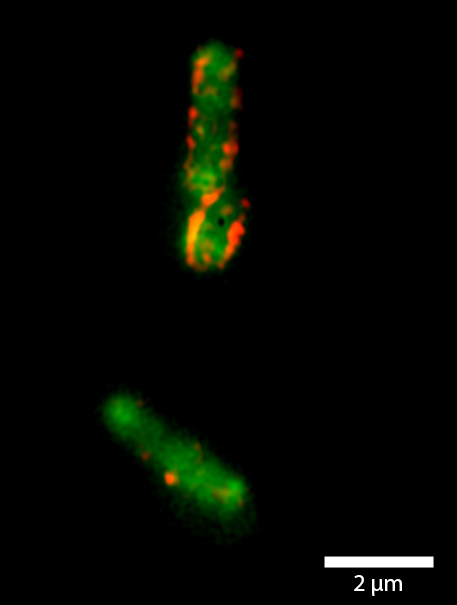
Seit Januar 2012 ist am Center for Advanced Imaging (CAi) eine Anlage im Einsatz, die nach dem Prinzip von Betzig und Moerner arbeitet, ein „STORM/PALM-Gerät“. STORM steht hier für Stochastic Optical Reconstruction Microscopy, PALM für Photoactivated Localization Microscopy. Das Düsseldorfer Mikroskop (Zeiss Elyra PS.1) arbeitet mit einer Variante eines häufig eingesetzten Fluoreszenzfarbstoffs, dem „grün fluoreszierenden Protein“ (GFP). Diese Variante kann durch Licht bestimmter Wellenlängen und Intensitäten gezielt aktiviert und auch deaktiviert werden. Im Mikroskop werden durch bestimmte Umgebungsbedingungen zu einem Zeitpunkt nur wenige Fluoreszenzmoleküle aktiviert und danach gezielt zur Fluoreszenz angeregt, die Moleküle „blinken“. Haben sie einmal ihr Fluoreszenzlicht abgestrahlt, sind sie gebleicht und können nicht ein zweites Mal strahlen. Man nimmt nun eine Serie von einzelnen Bildern dieser blinkenden Moleküle auf, von denen man weiß, dass jedes Lichtsignal zu einem anderen Protein gehört. Jedes einzelne Lichtsignal kann anschließend mit Hilfe einer Software mit sehr hoher Genauigkeit lokalisiert werden und aus den Einzelbildern kann ein Bild der gesamten Struktur errechnet werden, welches eine deutlich höhere Auflösung hat, als es die optischen Gesetze des Mikroskops erlauben würden.
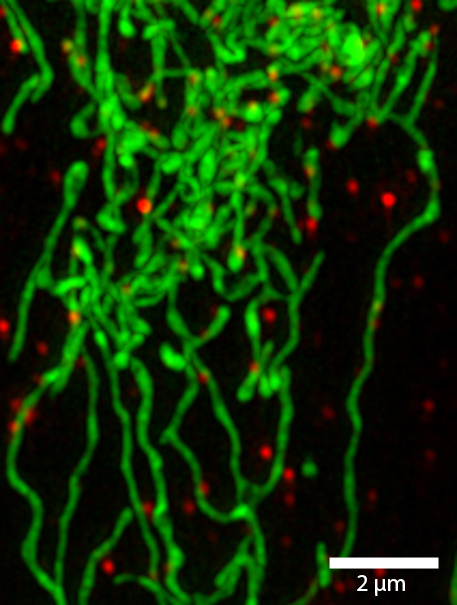
Außerdem bietet das ELYRA-System die Methode der so genannten strukturierten Beleuchtung („Structured Illumination Microscopy (SIM))“. Auch mit dieser Methode kann die Auflösung bis auf 100 Nanometer in x-y- Richtung verbessert werden. Diese Methode kommt bereits in vielen Forschungsprojekten an der HHU zum Einsatz, unter anderem zur Untersuchung der (Ko-)Lokalisation von Mitochondrien mit RNA-Molekülen oder der Anordnung von Proteinen auf der Oberfläche von Bakterien.
Darüber hinaus stellt das CAi aktuell ein so genanntes STED-Mikroskop auf und wird es noch im Dezember 2014 in Betrieb nehmen. Dieses Mikroskop basiert auf einem Ansatz, den Stefan Hell 1994 als so genannten „Stimulated Emission Depletion“ (STED) beschrieb. 1999 verwirklichte er diesen Ansatz auch experimentell als STED-Mikroskop. Bei dieser Technik werden wiederum zunächst die Fluoreszenzmoleküle angeregt, im Folgenden wird aber der allergrößte Bereich, ringförmig um den eigentlichen Messbereich, wieder abgeregt. Erst nach dieser Abregung nimmt man, nun aus einem sehr viel kleineren Fenster, das eigentliche Messlicht auf. Theoretisch kann, durch geeignete Wahl des ringförmigen Abregungsbereichs, die Größe des Messbereichs sehr klein – wenige Nanometer – und damit die Auflösung fast beliebig gut gemacht werden.
„Mit dem neuen STED-Mikroskop ist es dann auch möglich, die Auflösungsgrenze bei der Untersuchung lebender Zellen zu unterschreiten. Somit können wir erstmals auch zeitliche Abläufe wie Transport- und Stoffwechselprozesse mit einer Auflösung von deutlich weniger als 100 Nanometer untersuchen“, so Dr. Stefanie Weidtkamp-Peters vom CAi. „Dies ist mit den beiden bisher an der HHU verfügbaren Superresolution-Techniken noch nicht möglich.“
Center for Advanced Imaging
Um die Kompetenzen in der Bildgebungen zu bündeln, wurde an der HHU das Center for Advanced Imaging (CAi) gegründet. Inzwischen stehen mehr als zehn verschiedene optische und auch Elektronenmikroskope zur Verfügung, die jeweils für sehr verschiedene Fragestellungen aus der Biologie, Chemie, Physik und Medizin eingesetzt werden können. Häufig gibt auch erst die kombinierte Bildinformation aus mehreren Geräten ein aussagefähiges Gesamtbild.
Neben dem Gerätepark, der zukünftig nach der Fertigstellung der neuen 26er-Gebäude in einem Trakt untergebracht werden, bündelt das CAi die Expertise für verschiedenste Fragestellungen der Bildgebung. Alle Forscher aus Arbeitsgruppen der HHU und auch von externen Partnern können darauf zurückgreifen.
Kontakt
Dr. Stefanie Weidtkamp-Peters
Center for Advanced Imaging
Heinrich-Heine-Universität Düsseldorf
Tel.: 0211-81 11682